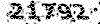کلاس اموزش
در اینجا از اموزشات لذت ببرید
کلاس اموزش
در اینجا از اموزشات لذت ببریداموزش درصد خلوص
مطالب را در ادامه مطلب بخوانید
مسائل درصد خلوص
:این مسائل سه نوع می باشند
نوع اول : در این نوع مسائل جرم ماده ی ناخالصX همراه با درصد خلوص آن داده می شود و ماده ی دیگری از معادله ی شیمیایی خواسته می شود .
در این صورت ابتدا جرم ماده خالصX را بدست آورده و سپس وارد رابطه استوکیومتری می کنیم .
جرم ماده خالصX به دو روش محاسبه می شود:
آ) با استفاده از فرمول درصد خلوص
ب) در ابتدای رابطه استوکیومتری به عنوان اولین ضریب تبدیل و به صورت P) P/100 :درصد خلوص ماده X می باشد) وارد شود
۵۰ گرم آلومینیوم کلرید با درصد خلوص ۸۰٪ در واکنش با سود سوزآور چند گرم آلومینیوم هیدروکسید ایجاد می کند ؟
AlCl3 + 3 NaOH __________> 3NaCl + Al ( OH )3
80 =( g AlCl3 ÷ 50) × 100 __________> AlCl3 = 40g
? g Al ( OH )3 = 40 g AlCl3 × 1 mol AlCl3 / 133/5 g AlCl3 × 1mol Al ( OH )3 / 1mol AlCl3 ×
78 g Al ( OH )3 / 1mol Al ( OH )3 = 23/37 g Al ( OH )3
نوع دوم : در این نوع مسائل جرم یک ماده خالص(X) را می دهند و بر اساس آن جرم ماده ناخالصی(Y) را می خواهند که درصد خلوص آن را داده اند . (درصد خلوص مربوط به ماده ای است که جرم آن سوال شده است)
در این صورت ابتدا با استفاده از مقدار ماده خالص(X) از روابط استوکیومتری مقدار ماده ی خالص(Y) را پیدا می کنیم.سپس با استفاده از هر یک از راه های زیر جرم ماده ناخالص (Y) را پیدا می کنیم:
آ)در انتها با استفاده از فرمول درصد خلوص جرم ماده ی ناخالص را پیدا می کنیم
ب) آخرین عددی که از روابط استوکیومتری بدست می آید در معکوس درصد خلوص ضرب می کنیم .
یا به عبارت دیگر به عنوان آخرین ضریب تبدیل و به صورت P) 100/P :درصد خلوص ماده X می باشد) وارد روابط استوکیومتری شود
برای تهیه ی ۴۰ گرم هیدروژن از واکنش آلومینیوم با HCl چند گرم پودر آلومینیوم با درصد خلوص ۸۵٪ نیاز است ؟
2Al + 6HCl __________> 2AlCl3 + 3H2
? g Al = 40g H2 × 1 mol H2 / 2gH2 × 2 mol Al / 3 mol H2 × 27 gAl / 1 mol Al × 100 / 85 = 423/5 g Al
نوع سوم : در این نوع مسائل مقدار ماده ی ناخالص X را می دهند و درصد خلوص آن سوال می شود.
معمولاْ این عدد را وارد روابط استوکیومتری نمی کنیم . آن را کنار گذاشته و با استفاده از روابط استوکیومتری مقدار ماده ی خالص X را به وسیله ی داده های دیگر مسئله(جرم ماده خالص Y) حساب کرده و سپس در فرمول درصد خلوص گذاشته و مقدار ماده ی خواسته شده (X) را محاسبه می کنیم .
از واکنش ۱۲۰ گرم کلسیم کربید ناخالص در آب ۳۹ گرم گاز استیلن حاصل شده است . تعیین کنید درصد خلوص کلسیم کربید چقدر است ؟
CaC2 + 2H2O __________> Ca (OH)2 + C2H2
(۹۶÷۱۲۰) × 100 = ۸۰٪ =درصد خلوص